患者さん・一般の方へ
治験について
病気でくるしんでいる大切な人のためにできることがあります。
新しい薬の誕生を待っている人がいます。
皆さんは「治験」という言葉を聞いたことがありますか?
「お薬」の目覚しい進歩で今まで治らなかった病気が治ったり、苦痛が和らいだり、病気の予防をすることができるようになってきました。しかし、まだまだ病気で苦しんでいる多く患者さんが、画期的な効能を持つ新しい「お薬」や海外では使えるが日本ではまだ使えない「お薬」を待ち望んでいるのも事実です。
新しい「くすり」を開発するためには、「くすりの候補」について試験管の中での実験や動物実験により、病気に効果があるかどうか、人に使用しても安全かどうかを調べます。ただ、動物と人では体のしくみが違うのでこの「くすりの候補」の開発の最終段階では、健康な人や患者さんの協力によって、人での効果と安全性を調べることが必要です。
人での有効性や安全性について調べる試験を一般に「臨床試験」と呼んでいますが、「くすりの候補」を用いて厚生労働省から「くすり」として承認を受けるために行う臨床試験のことを「治験」と呼んでいます。
私たちが今、使っている「お薬」もすべて治験を経て承認されたものです。つまり、過去、治験に参加された多くの患者さんのご好意とご協力によって創られたものなのです。
治験・臨床試験・臨床研究とは
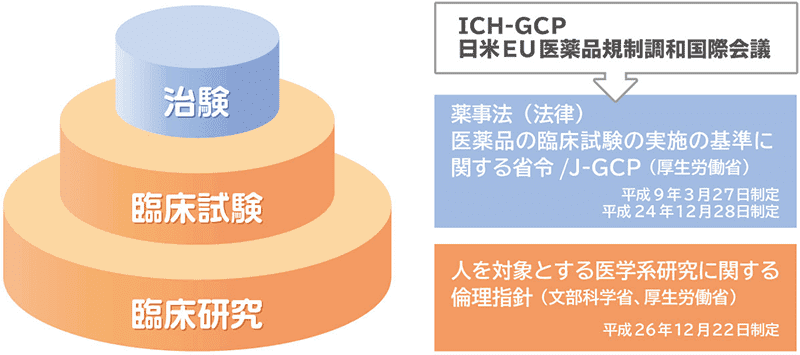
治験
治験は、法律に基づき、医薬品や医療機器の製造・販売の承認、許可を国(厚生労働大臣)から得るために実施する臨床試験をさします(行政用語の一つ)
臨床試験
臨床試験は、臨床研究のうち「介入」(通常の診療を超えた医療行為)を前向きに行い、予防・診断・治療の効果を調べるものです。聞き慣れた言葉に「適切な医療を実践するEBM」(Evidence Based Medicine:根拠に基づく医療)があると思いますが、その「エビデンス」は、実際に患者に適用した結果から生まれることが多く、EBMの確立には臨床試験が不可欠です。しかし、我が国のEBMの現状は、自国での臨床試験が少ないことから欧米におけるエビデンスに頼るところが多く、とても大きな問題になっています。
臨床研究
臨床研究は、疾患の予防・診断・治療の改善等を目的として実施する医学系研究の中で、「人」を対象とするもののことです。基礎研究や非臨床研究(細胞や動物を対象とするもの)に対比する言葉で、基礎研究の成果を臨床に応用するためには必須の過程です。専門誌に投稿される症例報告や色々な調査も臨床研究のひとつですが、研究方法としては大きく「観察研究」と「介入研究」の2つに分類されています。
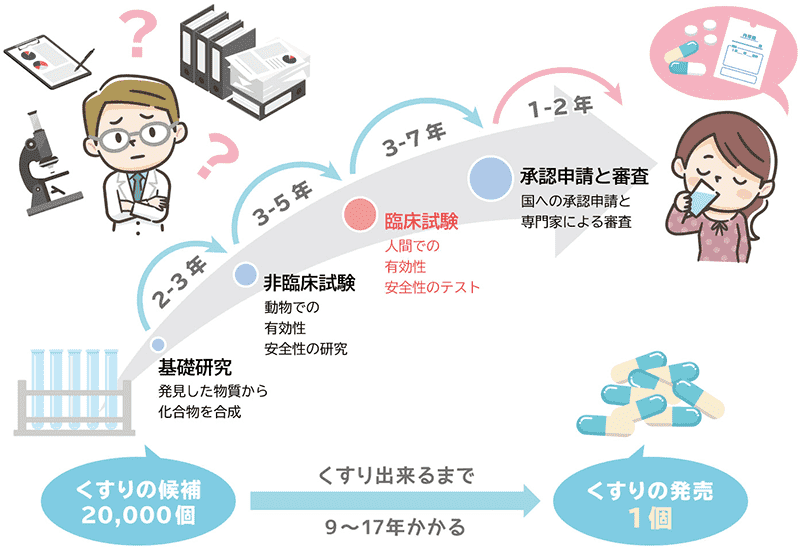
新しいお薬が誕生するまで
新しい薬が誕生するまでにおよそ9年~17年の歳月がかかります。そして、厚生労働省から安全性と有効性を認められたものだけが、最終的に薬として私たちの手元に届くのです。
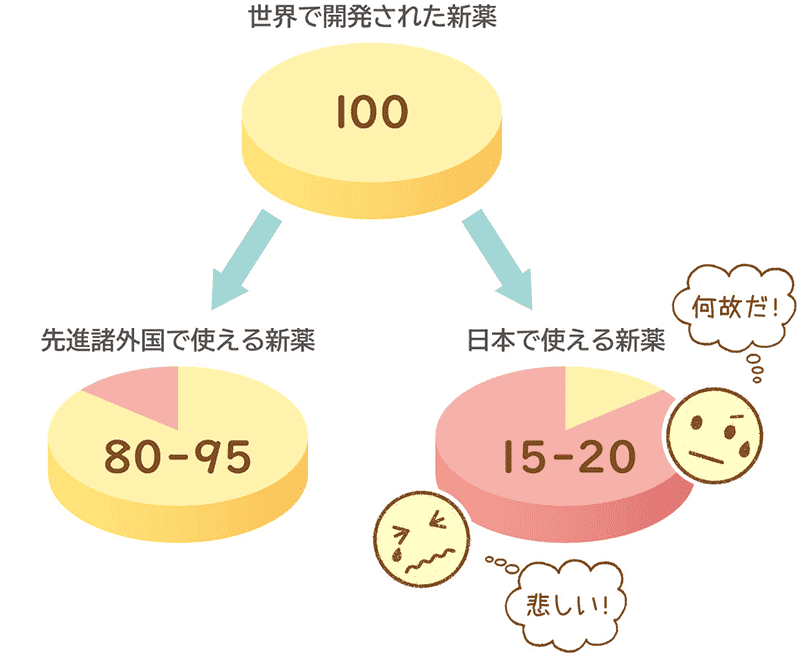
日本で新薬が使用できる割合
治験に参加される方の権利
治験には、厳しい規則や基準があります。治験は人を対象にした試験ですので、参加される方の権利と安全を守るために厳しい規則や基準が設けられています。
1.薬事法
製薬会社が治験を実施する際には、厚生労働省の定めた「治験実施のための基準」を守らなくてはなりません。
2.医薬品の臨床試験の実施に関する基準 GCP:Good Clinical Practice
人権や安全性がきちんと守られた中で、科学的に正確な情報が収集されるようルールが定められています。治験審査委員会(IRB)の設置、患者さんの人権保護、記録の保存など、治験に関するすべてのことに対して基準が設けられています。
3.治験の届出制度
製薬会社が治験を依頼するときは、その計画の内容を厚生労働省へ届けなければなりません。
治験に参加する製薬企業・医師・病院はこのルールを厳重に守り治験を適正に行わなければなりません。また、このルールをきちんと守っているか確認のために製薬会社や厚生労働省の監査担当者などが監査を行うことがあります。
4.治験審査委員会(IRB)の開催
治験審査委員会では、GCPやヘルシンキ宣言に基づき、全ての治験参加者の人権、安全及び福祉を保護し、倫理的、科学的及び医学的妥当性の観点から、治験の実施及び継続について厳格な審査を行っています。なお、治験審査委員会の委員は医師・メディカルスタッフ・薬剤師・医学専門家以外の学識経験者など多岐にわたっています。
5.治験の安全性について
製薬会社が治験を行うためにはその計画の内容を前もって厚生労働大臣に届出をします。そして、その内容に問題ないと判断された場合のみ治験を実施することが出来ます。
- 今まで知られていなかった効果や副作用などの治験薬に関する新しい情報が得られた場合には、きちんとご説明いたします。
- 治験期間中は通常の診療で行われる検査よりもより細かな検査も行い、異常の早期発見に努めます。
- 万が一副作用が起こって治験薬との関連が認められた場合は、きちんとした補償を受けることが出来ます。
- どの病院でも治験が実施できるわけではありません。治験を行う病院は、倫理的・科学的に治験が実施できる設備と人員が整っています。
臨床研究(治験)コーディネーターCRCについて
臨床研究(治験)コーディネーターは、患者さんの立場に立ち、
治験が安全に正しく行われるようにサポートします。
- ★治験て何?
- ★本当に大丈夫?
- ★参加するにはどうしたらいいの?
など、聞きたいことはたくさんあるでしょう。
心配なこと、わからないこといつでもご相談に応じます。
- ★こんなこと聞いていいのかな?
- ★先生には聞きにくいな~
- ★どんなことに気をつけたらいいの?
なんて思ったことありませんか?どんなことでもかまいません。
私たち臨床研究(治験)コーディネーターが安心して治験に参加できるようにサポートいたします。
沖縄県立中部病院の臨床研究(治験)コーディネーターはいずれも経験豊かなメディカルスタッフです。様々な現場でメディカルスタッフとして働いてきた上で、そして現在臨床研究(治験)コーディネーターとして治験をサポートしています。スムーズに治験を進行させ、新薬を待っている方に一日でも早くよいお薬を提供できるよう日々業務に当たっています。
臨床研究(治験)コーディネーターの仕事とは?
臨床研究(治験)コーディネーター
CRC(Clinical Research Coordinator)ともいわれ、治験を含め病院で行われる臨床研究全般がスムーズに行われるように院内で調整、サポートを行う役割を担っています。
臨床研究(治験)コーディネーターの役割
治験の倫理性・科学性・患者さんの人権・安全を医師とともに保証することが大きな役割です。
インフォームドコンセント(Informed Consent)
治験の内容をわかりやすく説明します。
- 治験の基準に合う方に、医師が説明します。その後臨床研究(治験)コーディネーターから詳細な説明を行います。
- 説明する内容は、治験説明文書という詳しく書かれたものを元に行います。治験の目的、治験の方法、治験の薬の効果や安全性、治験参加中に健康を害した場合の対処の方法や補償などについて書かれています。患者さんの病気・治療・生活など全体を考えて治験に参加することのメリット・デメリットを話し合い、納得した上で参加していただけるように心がけています。
- 説明を聞いてすぐ返事する必要はありません。説明文書を持ち帰っていただき、ご家族の方と話し合ってから参加を決めることもできます。また、ご家族の方が直接説明を聞きたいということであれば、もう一度一緒に説明させていただきます。
患者さんとの面談・診察への同席
治験に参加中は、検査や診察に同席して患者さんをサポートします。また、検査や診察の合間に面談を行い、治験に対する不安や疑問、通院のスケジュールの調整、身体の状態などのお話をさせていただきます。直接医師に言いにくいことなどがございましたらなんでも気軽におっしゃってください。
薬の飲み方などの指導、併用薬剤のチェック
治験のお薬の飲み方を説明します。また、治験参加中は一緒に飲んではいけないお薬などがあります。医師や臨床研究(治験)コーディネーターがそういったお薬がないかチェックを行います。また、他の病院に通院されている場合、患者さんの承諾を得てから、他院の医師に治験参加の期間、併用してはいけないお薬についてのご案内を行います。患者さんには、「治験参加カード」をお渡し、治験に参加中であることがわかるようにしています。
臨床研究(治験)のデータの収集や書類の管理
治験のために行った検査の結果などは、「症例報告書」という報告書類に記入され、製薬会社に提出されます。提出された報告書はデータとして解析され「くすり」としての承認を受けるための資料として厚生労働省に提出されます。
- カルテに書かれた医学的な判断を伴わないデータについては臨床研究(治験)コーディネーターが記入して医師をサポートしています。
- 治験が開始されてから終了するまで沖縄県立中部病院で治験がきちんと行われているかどうか製薬会社や製薬会社から委託された会社また、医薬品医療機器総合機構(くすりの承認に必要なデータが正しくとられているかを確認するところ)が患者さんのカルテを直接見て、報告書に記入されているデータが正しいかどうかを確認に来ます。その際、臨床研究(治験)コーディネーターは確認作業がスムーズに行われるようにサポートします。
- カルテを確認するといっても、患者さんのお名前や住所などプライベートに関わることが他人に漏れることは決してありません。
関連部署との連絡や調整
治験を行うためには、医師・メディカルスタッフ・薬剤師・臨床検査技師・放射線技師・医事課など様々な部署の協力が必要です。私たち臨床研究(治験)コーディネーターはそれぞれのスタッフの方々との連絡・調整を行い、臨床研究(治験)がスムーズすすむように働きかけています。
最後に
臨床研究(治験)コーディネーターがあなたを全面的にサポートします。なんでも相談してください。
いつでも相談に応じます。
治験参加のメリット・デメリット
治験参加のメリットは?
- 海外で承認されていて効果が認められている薬や、新しく開発された薬をいち早く試すことができます。
- 通常の診療より細やかな診察・詳しい検査が行われるので自分の病気の状態を正確に知ることができます。
- 臨床研究(治験)コーディネーターという専門のスタッフがあなたの担当について全面サポートするので安心です。
- 治験薬や検査にかかる費用の全額(または一部)を製薬会社が負担するので通常の診察より医療費がかかることはありません。
- 治験で来院する際の交通費補助として負担軽減費をお渡しします。
- 同じ病気で悩む将来の患者さんたちに画期的な新薬を残すという社会貢献もできます。
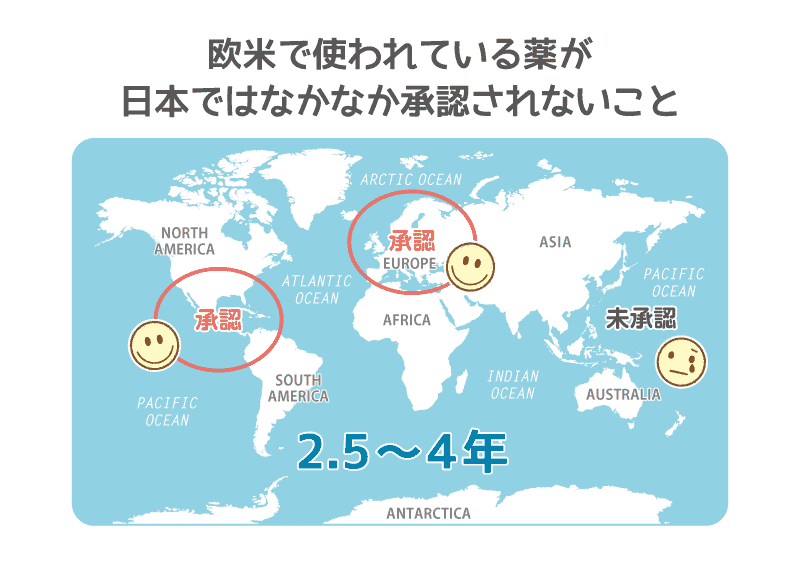
ドラッグ・ラグ(デバイス・ラグ)
治験参加のデメリットは?
- より詳しく病気の状態をみるため、検査の種類や受診日が増えるなど通常の診察の流れとは変わってくる場合があります。
- 正確な試験結果を得るため、定期的に診察を受ける、服用方法を守るなど、患者さん自身にも守っていただくことが多くなります。
現在実施中の治験
| Phase | 領域 | 実施診療科 | 実施症例/契約症例 | 状況 |
|---|---|---|---|---|
| Ⅲ | 妊娠高血圧腎症 | 産科/婦人科 | 6/6例 | 実施中 |
| Ⅱ | 線維化性間質性肺疾患 | 呼吸器内科 | 0/5例 | 実施中 |
2022年2月1日現在
よく寄せられる質問
-
一般的には診察料(初診料・再診料)は自己負担です。治験薬は製薬会社から提供されるので費用はかかりません。また、治験薬の服薬期間中は検査代についても患者さんのご負担はありません。
-
いいえ、内容や説明をご理解いただき、ご自身の意思で参加するかどうかを決めていただけます。納得するまでじっくり考えたり、家に持ち帰ってご家族と相談することもできます。
-
はい、大丈夫です。いつでも治験を止めることができます。どうぞ担当医師や臨床研究(治験)コーディネーターにその旨をお申し出下さい。治験で使われていたものから標準的な薬に変更してあなたの治療を続けます。
-
治験中は通常の治療より検査回数を増やし、皆さんに何か普段と違うことが起きていないか細心の注意を払っております。もし治験薬を服用していて「おかしいな」と感じたらすぐに治験担当医師にお知らせください。万が一、副作用が起きてしまった場合には速やかに適切な治療が行われます。
-
はい、お知らせします。治験中に重大な副作用などが起きた場合には速やかに病院から製薬会社に連絡し、製薬会社から同じ治験を実施している全ての病院に連絡されます。副作用の報告を受けた製薬会社は定められた期限内に厚生労働省に報告し、必要な場合治験の見直しをします。
-
治験で得られたデータは学会や医学雑誌などに公表される場合がありますが、患者さんを特定できるような個人情報が公開されることはありません。また、厚生労働省や製薬会社が治験が正しく行われているかカルテをチェックすることがありますが、その場合にも患者さん個人データ(氏名、住所、病歴など)が公表されることは決してありません。